Gas ideal telah lama menjadi landasan bagi pemahaman kita tentang perilaku gas di alam semesta ini. Konsep yang sederhana namun sangat relevan ini telah membantu ilmuwan memahami bagaimana gas berinteraksi dan bereaksi dalam berbagai kondisi.
Dengan menyelami prinsip dasar gas ideal, kita dapat menjelajahi fenomena yang melibatkan tekanan, volume, dan suhu gas dalam situasi ekstrim sekalipun.
Artikel ini akan membahas lebih dalam tentang apa itu gas ideal, hukum-hukum yang mengatur perilakunya, serta aplikasi praktis dari konsep ini dalam berbagai bidang ilmu, dari fisika hingga teknologi modern.
Gas Ideal
Aplikasi prinsip-prinsip dasar termodinamika pada mesin menggunakan fluida kerja yang dianggap ideal. perumusannya adalah sebagai berikut:
pv = mRT
dengan R = Ru / M (Konstan gas)
= 0,2870 Kj / Kg . K (untuk udara)
Ru = 8,31447 kj / kmol.K (konstan gas ideal)
Persamaan keadaan gas ideal
Gas ideal adalah gas yang dalam setiap keadaaan mematui persamaan keadaan gas ideal yaitu:
pV = mRT
pv = RT
dengan R = adalah konstanta gas spesifik, untuk udara R = 286,8 J/kg K
pada suatu siklus termodinamika persamaan keadaan prosesnya selalu berubah mengikuti beberapa proses yang saling terkait. ada tiga besaran yang selalu terkkait dan bisa diukur langsung yaitu tekanan (p), temperatur (T), dan volume (V). adapun proses keadaan termodinamika adalah sebagai berikut:
Proses Volume Konstan
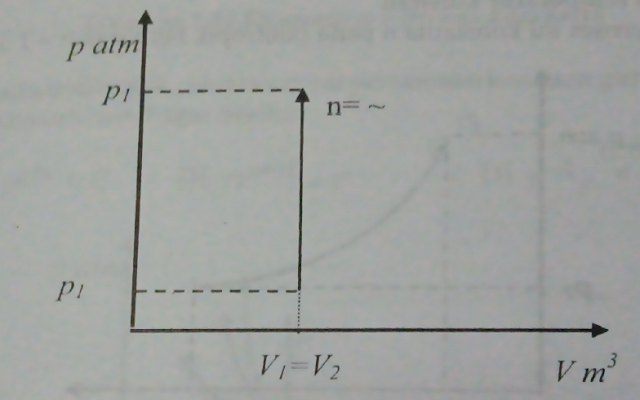 |
| Gambar 1.15 - diagram p-v proses volume konstan |
Proses Tekanan Konstan
Pada proses ini konstanta n pada politropik berharga n = 0 dan p=C
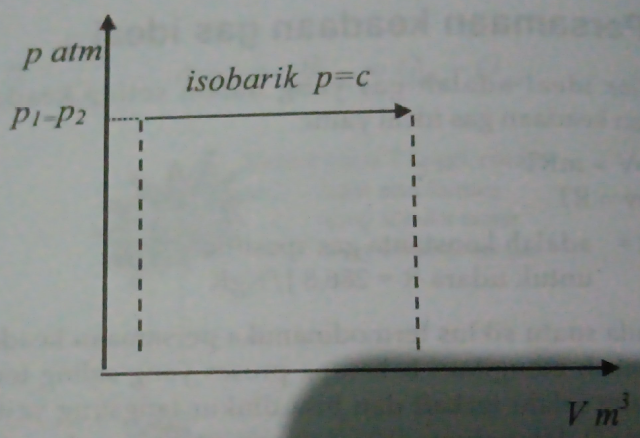 |
| Gambar - Diagram p-v proses tekanan konstan |
Proses Temperatur konstan
Pada proses ini konstanta n pada politropik brharga n = 1 dan T=C
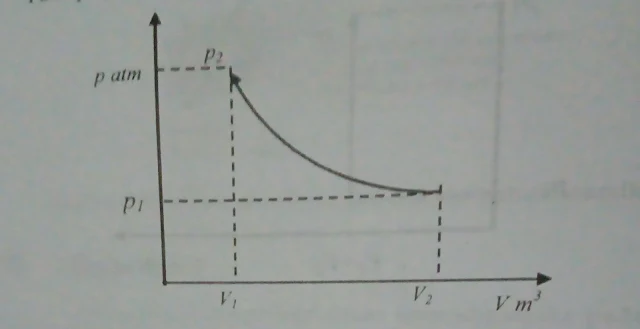 |
| Gambar p-v proses temperatur konstan |
Adiabatis (dq = 0)
Pada proses ini konstanta n pada politropik n = 1 dan T=C
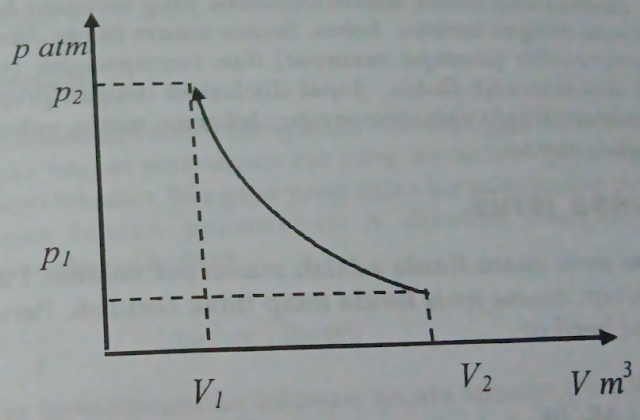 |
| Gambar diagram p-v proses adiabatik |
Proses Poltropik
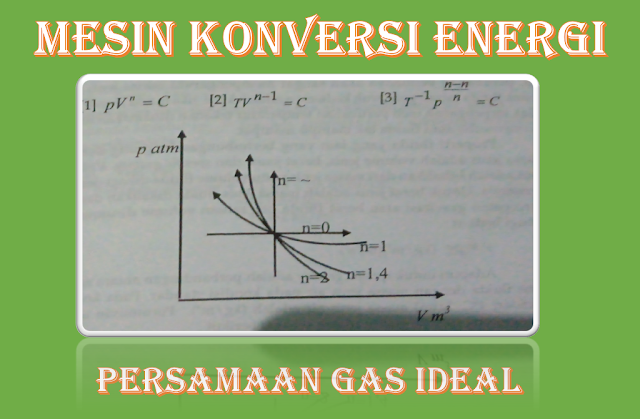
Seacara umum persamaan keadaan gas ideal dapat dirumuskan sebagai berikut:
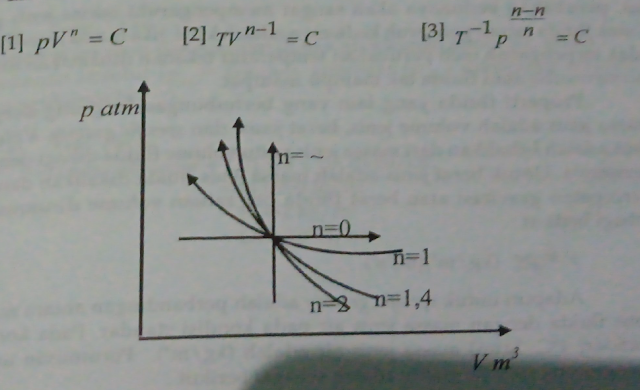 |
| Gambar daigram p-v proses politropik |
Related Posts
Mau donasi lewat mana?
Donate with PaypalGopay-